Показано материалов: 7841-7845
|
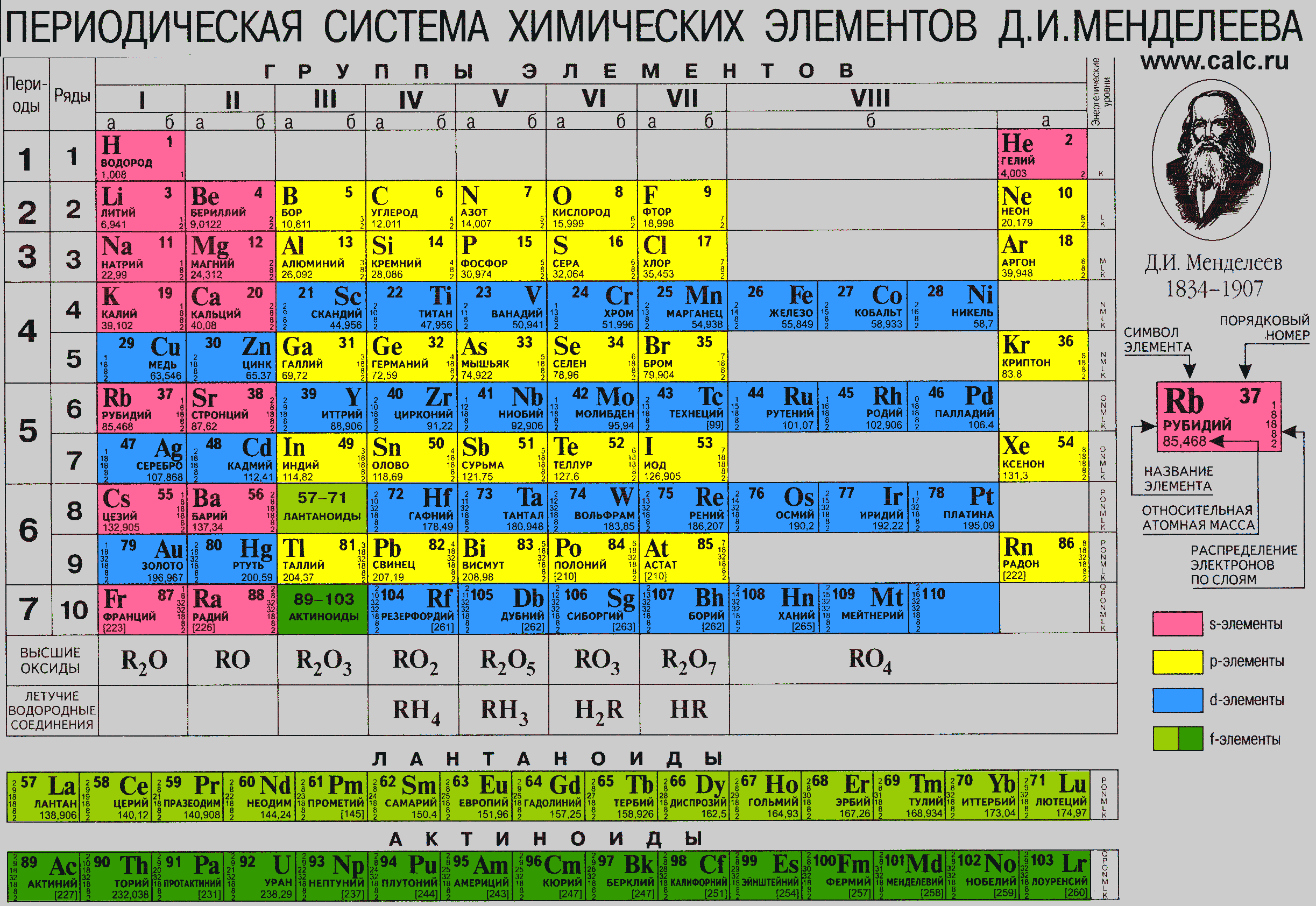
Химические элементы. Кратко
Химические элементы — самые простые вещества в при-1% роде, состоящие из атомов, в ядрах которых содержится одинаковое число протонов («атомный номер»). Ядро окружено оболочкой из отрицательно заряженных электронов; они нейтрализуют положительный заряд атомного ядра, в результате чего заряд атома становится нейтральным. Каждый химический элемент имеет свой стандартный символ, например, у водорода это Н, а у железа Fe. Водород — самый легкий химический элемент, он состоит из протона и электрона, а элементы, чья масса больше массы урана, атомный номер которого 92, неустойчивы и легко подвергаются радиоактивному распаду. Химические элементы расположены в периодической таблице рядами, по которым можно проследить некоторые тенденции. Так, атомный номер увеличивается слева направо, а элементы, расположенные в одной колонке, имеют схожие химические свойства. К примеру, в крайней правой колонке находятся неон и аргон — инертные газы, почти не образующие соединения. Дело в том, что у элементов из одной колонки одно и то же количество электронов на внешней оболочке атома, поэтому такие элементы обладают похожими свойствами. |
|
Структурные формулы в химии. Кратко Структурная формула молекулы показывает порядок связи атомов внутри нее. Например, если химическая формула этанола — это С2Н60, то его структурная формула выглядит следующим образом — СН3-СН2-ОН. Из нее видно, что метиловая группа (СН3) присоединяется к углероду метиленовой группы (СН2), которая, в свою очередь, крепится к кислороду гидроксильной группы (ОН). Существуют различные способы изображения структурных формул. Среди них — структура Льюиса, в которой показано соединение атомов. Проекция Натта показывает расположение молекул в трех измерениях, где сплошные и пунктирные треугольники отображают направления связи: к зрителю либо от него, соответственно. Для изображения сложных органических молекул часто используются «скелетные формулы», в которых шестиугольник может изображать формулу бензина, например (С6Н6). Для упрощения в скелетных формулах нет специального обозначения углерода или водорода — углерод располагается в верхней части формулы, плюс достаточное количество водорода для построения четырех связей. |
|
Растворы и соединения в химии. Кратко
Атомы различных элементов могут вступать в химические реакции и образовывать соединения. Например, в результате реакции водорода с кислородом получается вода (Н2О). Химические свойства соединений обычно отличаются от свойств элементов, из которых они состоят: водород и кислород — газы, а вода — это жидкость. В соединениях содержится фиксированное соотношение атомов, которые держатся вместе благодаря химическим связям. Разделить атомы можно только с помощью химической реакции. В отличие от соединений, смеси состоят из одного или более веществ, не соединенных химически. Разделить вещества в смеси можно путем простых манипуляций, таких как фильтрация или выпаривание. И смесям относятся сплавы, например сталь (железо с углеродом), а также раствор соли в воде. Коллоиды — это смеси, в которых частицы вещества равномерно распределены по всей среде. К коллоидам относится эмульсионная краска. Существуют также суспензии — жидкости, содержащие твердые частички, которые постепенно выпадают в осадок. |
|
Полярность химических связей. Кратко
Полярные молекулы — это молекулы, электрический заряд в которых распространен неравномерно. Одна сторона такой молекулы имеет положительный заряд, а другая — отрицательный. Молекулы воды являются полярными. На той стороне молекулы, где располагаются два атома водорода, образуется избыточный положительный заряд. Атомы водорода связаны с кислородом посредством двух общих электронов. Со стороны кислорода также есть две пары свободных электронов, поэтому на этой стороне заряд молекулы отрицательный. Молекулы воды, как правило, присоединяются так, чтобы отрицательно заряженная сторона одной молекулы соседствовала с положительно заряженной стороной другой молекулы. Так образуется второстепенный вид связи — водородная связь. Именно благодаря данной связи вода в замороженном виде имеет форму кристалла, а в жидком состоянии ее плотность больше, чем в твердом. Поэтому в холодную погоду зимой, когда на озере образуется лед, он поднимается на поверхность воды и защищает все озеро от замерзания. |
|
Кристаллическая структура. Кратко
Кристалл или кристаллическое тело — это структура, в которой положение атомов или молекул четко упорядочено и многократно повторяется. Поваренная соль, снежинки, бриллианты — все это примеры кристаллов. Кристаллические породы образуются в растворах либо при охлаждении раскаленной магмы. К примеру, формирование кристаллизованного гранита происходит, когда магма остывает и становится очень твердой под воздействием высокого давления. Кристаллы могут иметь форму простой кубической решетки с одним узлом решетки на каждой вершине куба, а также форму объемно-центрированной решетки с узлом в центре куба. В гранецентрированной кубической структуре узлы решетки находятся в середине граней куба. Структура обычной поваренной соли образует гранецентрированную кубическую решетку с чередующимися атомами натрия и хлора. Некоторые кристаллы могут формировать более сложные структуры, как, например, двойные пирамиды и восьмигранный октаэдр. Для изучения кристаллических структур ученые обычно используют рентген, а затем изучают дифракционные структуры. |