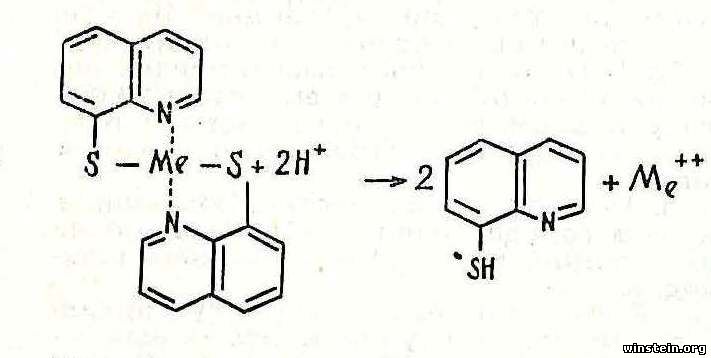
| Тиооксин
(статья из журнала Наука и Техника, от февраля 1964 г.)
Развитие атомной энергетики и полупроводниковой техники, применение редких и редкоземельных элементов, производство ультрачистых металлов и сплавов — все это ставит перед современной химией новые и весьма сложные проблемы. Технология особо чистых материалов, получение чистых редких элементов и анализ их смесей (ввиду предельной близости свойств этих элементов) — одна из труднейших задач неорганической и аналитической химии. В решении перечисленных вопросов широкое применение находят органические комплексообразователи, которые образуют с металлами комплексные или внутрикомплексные соединения с особыми свойствами. Органические комплексообразователи вследствие большого разнообразия их свойств могут селективно реагировать с ионами одних элементов и совершенно не реагировать с другими. Селективность, то есть способность избирательно реагировать с одним или несколькими элементами, не затрагивая другие в этом же растворе, зависит от строения молекулы органического реагента, природы и положения различных заместителей в молекуле реагента, свойств солеобразующих и координационно активных групп. Отсюда следует, что свойства органических комплексообразователей, а следовательно, и их реакционную способность с ионами металлов можно изменять в широких пределах. Ценным качеством органических комплексообразователей является также их высокая чувствительность к ионам металлов. Образующиеся комплексные или внутрикомплексные соли часто почти совершенно не растворимы в воде и выделяются в виде осадков, что позволяет выделять из водных растворов очень малые количества металлов. В то же время эти соединения во многих случаях хорошо растворяются в органических растворителях, что дает возможность извлекать из водных растворов очень малые количества металлов экстрагированием. Экстракционное извлечение металлов, широко применяемое в настоящее время в аналитической химии, в технологии расщепляющихся материалов и в металлургии редких элементов, имеет огромные преимущества перед другими методами разделения металлов. Исследовательская работа в области взаимодействия металлов с органическими веществами, то есть синтез и изучение свойств внутрикомплексных соединений, с каждым годом расширяется. И в аналитической химии ключевую позицию занимают внутрикомплексные соединения, применение которых часто является единственной возможностью решения сложнейших аналитических задач. С другой стороны, исследование внутрикомплексных соединений имеет большое значение для решения центральных вопросов теоретической химии: выяснения природы химической связи, условий проявления высоких валентностей металлов, природы донорно-акцепторного взаимодействия, реакционной способности веществ и т. д. Современный опыт развития аналитической химии показывает, что органические аналитические реагенты по чувствительности и селективности реакций имеют большие преимущества перед методами классического анализа. Наиболее характерным , примером является широкое применение 8-оксихинолина, по аналитическому применению которого во всем мире опубликовано более 600 исследований. Ни один другой аналитический реагент не подвергался столь тщательному исследованию, как 8-оксихинолин. И не случайно: ведь 8-оксихинолин (сокращенно — «оксин») образует с многочисленными металлами нерастворимые, часто ярко окрашенные, внутрикомплексные соли. На этом основаны весовые, объемные, колориметрические, полярографические, хроматографические, флотационные и флуоресцентные методы определения многих металлов. В связи с этим большой интерес представляет изучение 8-меркаптохи-нолина, серосодержащего аналога 8-оксихинолина: Теоретически можно было предполагать, что в отношении аналитических свойств 8-меркаптох инолин (тиооксин) будет обладать рядом весьма благоприятных особенностей. Ожидалось, что соли тиооксина с металлами (тиооксинаты) будут более интенсивно окрашенными, лучше экстрагироваться из водных растворов органическими растворителями и значительно более устойчивыми к действию кислот. Перечисленные свойства тиооксинатов должны привести к большей чувствительности, а в ряде случаев также селективности аналитических реакций. Исследования тиооксина представляют интерес также с теоретической стороны. Изучение кислород- и серосодержащих аналогов одинаковых по структуре реактивов имеет большое значение для создания представлений по общей теории действия органических аналитических реагентов. 8-мер-каптохинолин синтезирован в 1908 году А. Эдингером, однако вследствие довольно сложного метода синтеза он долгое время не был доступен для всестороннего изучения. В 1943 году американские химики после весьма поверхностного его изучения пришли к выводу, что для аналитического применения этот реактив непригоден. Но исследования, проводимые в течение ряда лет учеными Института химии АН Латвийской ССР, позволили в 1951 году убедительно доказать, что такое мнение американских химиков ошибочно. Об этом свидетельствовала очень высокая устойчивость многих солей тиооксина, их высокая интенсивность окраски и хорошая экстрагируемость большинством органических растворителей. Оказалось также, что устойчивость различных внутрикомплексных солей тиооксина к кислотам не одинакова. Это открыло перспективы для прямого фотометрического определения металлов в сложных смесях. В определенных условиях избирательность реакций на некоторые элементы оказалась так высока, что это дало возможность определять следы одних в присутствии сильно преобладающих количеств большинства других элементов. Применяя общепринятую терминологию, можно сказать, что оксин принадлежит к реагентам группы R—ОН, а тиооксин — к реагентам группы R—SH (R — хинолиновый радикал). Получается, что оксин представляет собой производное воды (Н20), а тиооксин — производное сероводорода (H2S), в молекулах которых один атом водорода замещен хинолиновым радикалом. В соответствии с теоретическими представлениями, развиваемыми видным советским ученым профессором В. И. Кузнецовым, оксин должен взаимодействовать в водных растворах с ионами металлов, образующими в водных средах трудно растворимые гидроокиси, а тиооксин должен образовывать устойчивые соли только с металлами, образующими не гидролизуемые водой сульфиды. Систематическое исследование физико-химических свойств внутрикомплексных солей тиооксина вполне подтвердило это предсказание теории. Поскольку элементов, осаждающихся из водных растворов в виде трудно растворимых сульфидов, меньше, чем элементов, образующих мало растворимые гидроокиси, тиооксин (по сравнению с оксином) более селективный аналитический реагент. Изыскание новых органических аналитических реагентов в современной комплексной химии проводится в двух направлениях. Применяются групповые и так называемые специальные реагенты. Если надо определить один элемент (например, медь) на фоне сильно преобладающих количеств многих других элементов, то в этом случае идеальным будет реагент, взаимодействующий только с определяемым элементом (например, медью) и в то же время совершенно инертный ко всем другим присутствующим в анализируемом веществе элементам. Создание таких высокоселективных реагентов является мечтой аналитика. Действительно, имея набор таких специальных (высокоселективных) реагентов на все элементы, любой, даже самый сложный объект, можно было бы анализировать крайне просто. В настоящее время теория взаимодействия металлов с органическими веществами еще не позволяет во всех случаях теоретически предсказать структуру органического реагента с заранее заданными аналитическими свойствами. Поэтому высокоселективных реагентов известно очень мало. В качестве примера можно привести обыкновенный крахмал —реактив на йод. Из всех известных элементов только один йод образует с крахмалом синее окрашивание. Подавляющее большинство аналитических реагентов в той или иной мере являются групповыми, то есть сравнительно мало селективными. Для повышения избирательности необходимо ограничить или полностью подавить взаимодействие этих реагентов с рядом элементов. Достигается это в основном тремя способами: 1) предварительным отделением мешающих элементов; 2) связыванием мешающих элементов так называемыми маскирующими комплексообразователями в комплексы более прочные, чем комплекс определяемого элемента с аналитическим реагентом; 3) созданием концентрации водородных ионов, при которой комплексы некоторых элементов с данным аналитическим реагентом не могут существовать. 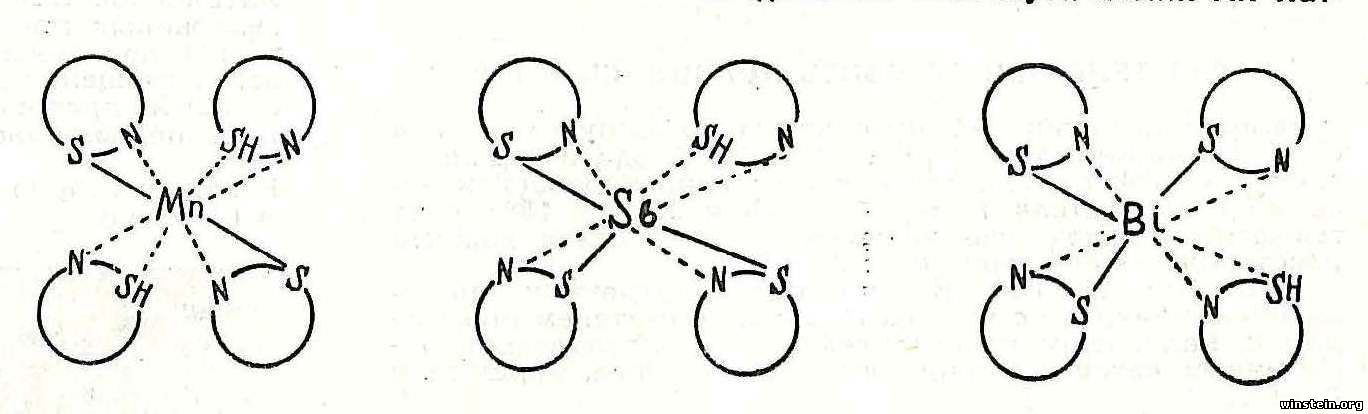
Если внутрикомплексные соли не растворимы в воде, но растворимы в органических растворителях, то есть могут быть экстрагированы из водной фазы, то относительная устойчивость комплексов может быть выяснена весьма просто: нужно определить зависимость образования комплекса от изменения концентрации водородных ионов в водной фазе — чем устойчивее внутрикомплексная соль, тем меньшее влияние на ее образование будут оказывать водородные ионы. Это означает, что образование комплекса будет распространяться в более кислую область. Устойчивость внутрикомплексных солей тиооксина пропорциональна устойчивости сульфидов соответствующих металлов. Из этого следует, что устойчивость внутрикомплексных соединений тиооксина зависит в основном от энергии связи металла с серой и, как показывают исследования, сравнительно мало от энергии связи металла с азотом хинолинового ядра. При изучении внутрикомплексных солей тиооксина нами найдено, что интенсивность окраски является прямолинейной функцией количества молекул реагента, связанных с центральным атомом (металлом). Это означает, что внутрикомплексные тиооксинаты, например, всех двухвалентных элементов, образующих соли состава Me Кг, имеют практически одинаковую интенсивность окраски. Следовательно, интенсивность окраски мало зависит от природы химических связей центральных атомов с молекулой тиооксина. Это позволяет теоретически вычислить фотометрическую чувствительность аналитической реакции тиооксина с любым элементом. Внутрикомплексные соли тиооксина обладают различной окраской, то есть имеют различные спектры поглощения. Поскольку окраска тиооксинатов зависит от природы металла, то очевидно, что причиной той или иной окраски является изменение энергии связей металлов с молекулой тиооксина. При изучении спектров поглощения внутрикомплексных солей тиооксина найдено, что максимумы поглощения сдвигаются в длинноволновую область спектра пропорционально увеличению энергии координационной связи металла с азотом хинолинового ядра. Такие элементы, как сурьма, висмут и другие, не способные образовать прочную координационную связь с азотом, обладают максимумами поглощения в ближней ультрафиолетовой области спектра, вследствие чего имеют желтую окраску. Тиооксинаты платиновых металлов, обладающих особенно высокой способностью к образованию координационных связей с азотом, поглощают в длинноволновой части видимой области спектра и имеют фиолетовую и сине-фиолетовую окраску. Тиооксинаты, других металлов как по способности к координации с азотом, так и по размещению максимумов поглощения занимают промежуточное -положение. Интенсивность окраски внутрикомплексных солей тиооксина является в общем аддитивной величиной, пропорциональной количеству молекул реагента, входящих в состав комплекса. Однако экспериментальная интенсивность окраски тиооксинатов в большинстве случаев оказалась или немного ниже, или немного выше теоретически вычисленной. Вначале казалось, что это не что иное, как отступление от простой и ясной закономерности. Но в дальнейшем было найдено, что повышение прочности координационной связи с азотом хинолинового ядра приводит к некоторому понижению интенсивности окраски, а увеличение прочности связи центрального атома (металла) с серой приводит к повышению интенсивности окраски внутрикомплексных солей тиооксина. Эта закономерность вместе с закономерностью сдвига максимумов поглощения в принципе дает, возможность судить об относительном межатомном расстоянии металл — сера и металл — азот. Важнейшей проблемой химии комплексных соединений является природа валентных сил атомов комплексообразователей. Для выяснения природы химической связи необходимо изучать элементы в различных, в особенности высоких, валентных состояниях. Вследствие наличия в молекуле тиооксина атомов азота и серы, обладающих высокой координационной активностью, образуются очень устойчивые циклические соли с металлами. Образование наиболее устойчивых (в большинстве случаев) пятичленных гетероциклов создает благоприятные условия для проявления высокой координационной валентности центральных атомов (металлов). Это предположение экспериментально подтвердилось. В нашем институте впервые синтезированы соединения марганца, сурьмы и висмута с координационной валентностью восемь: Кроме того, синтезирован ряд других очень устойчивых внутрикомплексных солей тиооксина, в которых атомы металлов находятся в ранее не известных или обычно мало устойчивых валентных состояниях. На основе полученных теоретических результатов в Институте химии АН Латвийской ССР были разработаны селективные и весьма чувствительные методы определения малых концентраций ряда металлов. В современной промышленности все большее значение приобретают редкие элементы, в особенности рений, содержание которого в земной коре составляет около 10 —8 процента. Трудности определения рения состоят не только в его малых концентрациях, но и в том, что известные на рений органические реактивы в тех же самых условиях реагируют также с обычными спутниками рения — молибденом и вольфрамом, которых в земной коре значительно больше рения. Для определения этого редкого элемента его обычно предварительно отделяют от молибдена, вольфрама и от ряда других элементов, что связано со значительным усложнением, уменьшением точности и удлинением Бремени анализа. С применением тиооксина задача определения рения решается просто. В определенных условиях селективность реакции тиооксина с рением столь высока, что позволяет определять микрограммовые количества рения в присутствии сильно преобладающих количеств молибдена, вольфрама и почти всех других элементов периодической системы. В определенных условиях высокой селективностью и чувствительностью обладает также разработанный в нашем институте метод определения микроколичеств меди тиооксином. Этот метод успешно применялся академиком Я. В. Пейве для определения меди в почвах Латвии. Большой интерес представляет колориметрический метод определения кальция в биологических материалах, разработанный нашим институтом совместно с Институтом биологии АН Латвийской ССР. Опыт Института биологии показывает, что этот метод обладает значительными преимуществами перед другими ранее применявшимися методами. Так, для определения кальция колориметрическим методом необходимо очень малое количество биологического материала (например, одна капля сыворотки), что очень важно не только в научно-исследовательской работе, но также для диагностики заболеваний. Кроме упомянутых, разработаны также чувствительные спектрофотометрические методы определения марганца, молибдена, индия, платины. В последнее время в лаборатории внутрикомплексных соединений открыт новый, значительно более селективный реактив на медь, чем тиооксин. В статье изложены некоторые результаты исследований, проводящихся в лаборатории внутрикомплексных соединений Института химии АН Латвийской ССР. Читатель вправе спросить: найденные закономерности свойств внутрикомплексных солей тиооксина являются частными, или они имеют более широкое значение? На это мы можем ответить, что в лаборатории проводятся исследования производных тиооксина с различными заместителями в молекуле. Оказалось, что свойства как самих производных тиооксина, так и их внутрикомплексных солей подчиняются тем же единым закономерностям. Есть основания полагать, что эти закономерности можно будет распространить и на другие классы внутрикомплексных соединений. | |
| Просмотров: 1919 | | |